Aluminium: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
|||
| Zeile 170: | Zeile 170: | ||
|style="height:100px; width:150px;text-align:center;" | [[Datei:Produktion.png|caption|150px]] | |style="height:100px; width:150px;text-align:center;" | [[Datei:Produktion.png|caption|150px]] | ||
| | | | ||
[[Datei:Standort Aluminiumhütten.png|thumb| | [[Datei:Standort Aluminiumhütten.png|thumb|400px|Abbildung 4: Standorte der Aluminiumhütten <ref name = "Friedrich"/>]] | ||
[[Datei:HerstellungsverfahrenAluminium.png|thumb|500px|Abbildung 5: Herstellungsverfahren von Aluminium mittels Bayer Verfahren und Schmelzflusselektrolyse (Verändert nach <ref name = "Raulf"/>)]] | [[Datei:HerstellungsverfahrenAluminium.png|thumb|500px|Abbildung 5: Herstellungsverfahren von Aluminium mittels Bayer Verfahren und Schmelzflusselektrolyse (Verändert nach <ref name = "Raulf"/>)]] | ||
Zur Herstellung des Aluminiums kommen verschiedene Prozessschritte zum Einsatz, die im Folgenden erläutert werden. Die Verteilung der Standorte der Aluminiumhütten ist in Abbildung 4 dargestellt. | Zur Herstellung des Aluminiums kommen verschiedene Prozessschritte zum Einsatz, die im Folgenden erläutert werden. Die Verteilung der Standorte der Aluminiumhütten ist in Abbildung 4 dargestellt. | ||
| Zeile 182: | Zeile 183: | ||
;Schmelzflusselektrolyse | ;Schmelzflusselektrolyse | ||
: Um metallisches Aluminium elektrochemisch in einer Elektrolysezelle gewinnen zu können, muss der Rohstoff Aluminiumoxid (Al2O3) zunächst in einem Elektrolyten in ionischer Form gelöst werden, so dass dann Aluminium durch eine elektrochemische Reduktion dargestellt werden kann. Es wird Kryolith (Na3AlF6) als (schmelzflüssiger) Elektrolyt verwendet, da es eine hohe Ionenleitfähigkeit und eine gute Löslichkeit für Aluminiumoxid besitzt. Aufgrund des hohen Schmelzpunktes von Aluminiumoxid (2046°C) elektrolysiert man nicht direkt geschmolzenes, reines Aluminiumoxid. <ref name = "Friedrich"/> | : Um metallisches Aluminium elektrochemisch in einer Elektrolysezelle gewinnen zu können, muss der Rohstoff Aluminiumoxid (Al2O3) zunächst in einem Elektrolyten in ionischer Form gelöst werden, so dass dann Aluminium durch eine elektrochemische Reduktion dargestellt werden kann. Es wird Kryolith (Na3AlF6) als (schmelzflüssiger) Elektrolyt verwendet, da es eine hohe Ionenleitfähigkeit und eine gute Löslichkeit für Aluminiumoxid besitzt. Aufgrund des hohen Schmelzpunktes von Aluminiumoxid (2046°C) elektrolysiert man nicht direkt geschmolzenes, reines Aluminiumoxid. <ref name = "Friedrich"/> | ||
: Die Schmelzflusselektrolyse wird mit Graphitanoden und Kohle als Kathode ausgestattet. Bei der Durchführung der Elektrolyse setzt sich an der Kohlekathode, die sich am Boden befindet, flüssiges Aluminium ab und kann abgesaugt werden. An der Graphitanode entsteht Sauerstoff, der zu CO und CO2 reagiert <ref name = "Seilnacht"/> <ref name = "GA_Schmelzelektrolyse"/> | : Die Schmelzflusselektrolyse wird mit Graphitanoden und Kohle als Kathode ausgestattet. Bei der Durchführung der Elektrolyse setzt sich an der Kohlekathode, die sich am Boden befindet, flüssiges Aluminium ab und kann abgesaugt werden. An der Graphitanode entsteht Sauerstoff, der zu CO und CO2 reagiert <ref name = "Seilnacht"/> <ref name = "GA_Schmelzelektrolyse"/> | ||
== Nutzung == | == Nutzung == | ||
Version vom 12. September 2021, 17:14 Uhr
|
|
Rohstoffe/Werkstoffe

|
Zur Herstellung von Aluminium wird der Rohstoff Bauxit benötigt, der ein eng verwachsenes Mineralgemenge von Aluminiumhydroxiden (Hydrargillit (γ-Al(OH)3), Böhmit (γ -AlOOH), Diaspor (χ -AlOOH)), Aluminiumoxiden (Korund (α -Al2O3)), Eisen-und Titanoxiden sowie Kieselsäure darstellt. Tabelle 1 zeigt verschiedene Bauxitarten unterschiedlicher Herkunftsregionen und deren Zusammensetzung. Die Rostrote Farbe erhält der Rohstoff durch seinen hohen Eisenanteil. [1]
Rohstoffvorkommen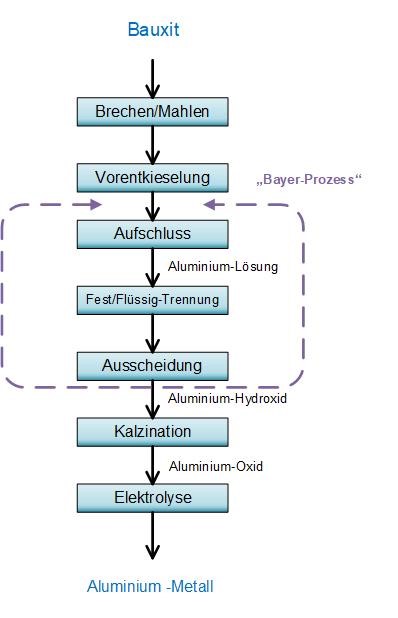 90 % der Vorräte liegen entlang des Tropengürtels. Der größte Bauxitabbau findet in Australien mit 83 Mio.Tonnen und in China mit 68 Mio.Tonnen statt. Eisenreiche europäische Bauxite sind schwer aufzuschließen und werden nur noch selten abgebaut. Die Rohstoffe befinden sich in oberflächennahen, sechs bis acht Meter mächtigen Schichten und der Abbau findet über Tage statt. Zur Zeit werden die abbauwürdigen Reserven auf ca. 200 Jahre geschätzt. [1]
AbbauverfahrenDas Ziel der Bauxitaufbereitung ist die Abtrennung des Eisenanteils und weiterer Verunreinigungen, sowie das möglichst selektive Auflösen von Aluminiumhydroxid. Der erste Schritt der Zerkleinerung teilt sich in zwei Schritte auf. Bei der Vorzerkleinerung werden Backenbrecher oder Hammerbrecher verwendet, um das Bauxit auf Korngrößen von 20 bis 50mm zu brechen. Eine weitergehende nasse Zerkleinerung wird mittels Kugel- und Stabmühlen durchgeführt. Das erzielte Kornspektrum hat Einfluss auf die Aufschließbarkeit des Bauxits, das Absetzverhalten des Rotschlamms und die Erosion der Anlagenbauteile. In vielen Fällen findet eine Waschung statt, um feinverteiltes Koalit aus dem Bauxit zu entfernen. Anschließend wird die feingemahlene Suspension in Vorratsbehältern gelagert, welche meist zur Vorentkieselung genutzt werden, der besonders kieselsäurereiche Bauxite noch vor dem Aufschluss einer SiO2-Abtrennung unterzogen werden. Die Aufbereitung und der Aufschluss erfolgen meist in der Nähe der Aluminiumoxid (Alumina) Fabrikanten. [1] Die Methodik der Aufbereitung und des weitergehenden Aluminiumgewinnung ist in Abbildung 3 dargestellt. |
Produktion

|
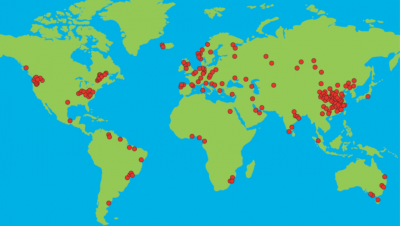 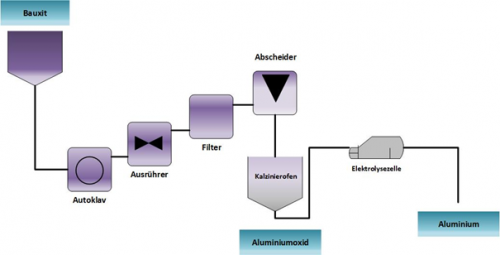 Zur Herstellung des Aluminiums kommen verschiedene Prozessschritte zum Einsatz, die im Folgenden erläutert werden. Die Verteilung der Standorte der Aluminiumhütten ist in Abbildung 4 dargestellt.
Nutzung
Rohstoff!
Literaturverzeichnis
|